
氷水はとっても冷たいですが、それだけではシャーベットなどを作ることはできません。しかし、この氷水にどのご家庭にもあるものを入れるだけで温度を急激に下げることができます。
それはもちろん『塩』ですよね。
では、なぜ塩を入れると氷水の温度は下がるのでしょうか?
氷が水に変わる融解熱と塩が氷水に解けること、さらにこの2つに加えて『凝固点降下』が起きているので温度がどんどん下がっていくのです。
凝固点降下とは何なのか?詳しく解説していきましょう。
1.個体から液体
皆さんもご存知だと思いますが、水は液体、氷は個体ですよね。また、氷から水になることを『融解』と言い、その温度を『融点』と呼んでいます。
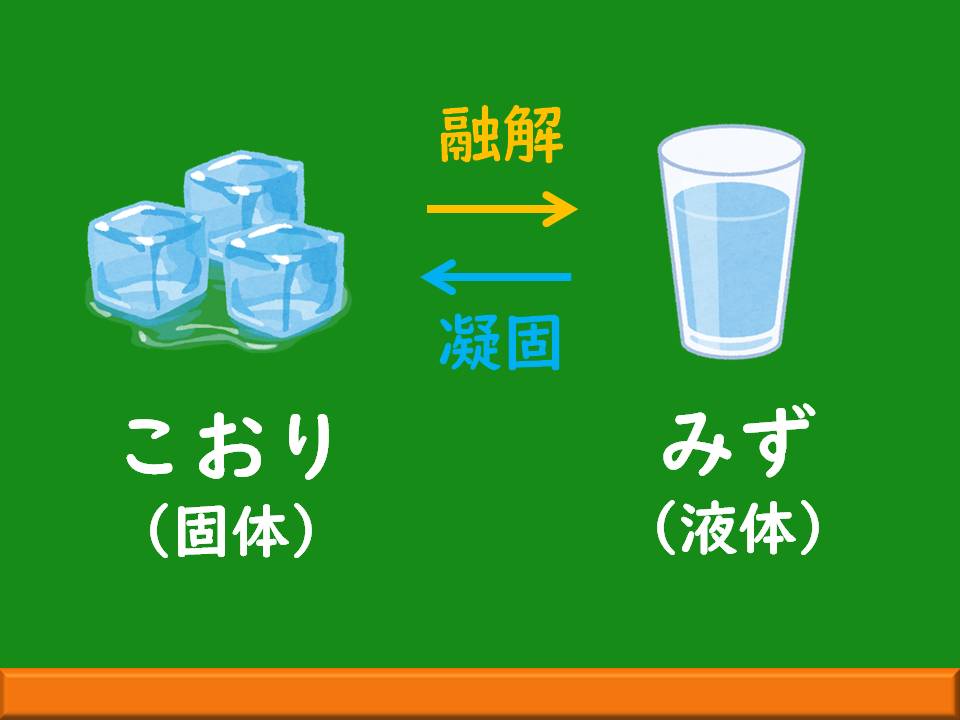
では、氷の融点は何度でしょうか?
正解は0℃です。氷は0℃で水に変わろうとします。そして、水が反対に氷に変わることを『凝固』、そしてその温度を『凝固点』と呼んでいます。
では、氷水を用意してください。室温はきっと0℃以上あるはずなので当然氷は解けていきます。
実は氷が解ける時にはエネルギーが必要なんです。氷は水分子がお互いに手を取り合ってしっかりと繋がっているため、硬い個体になっています。
水はどうでしょう?
水は自由に動き待っていますよね。つまり、氷よりもエネルギーが大きい状態です。そのため氷が水になるには周りからエネルギーを奪う必要があるのです。
そのため、氷は解けきるまでは一定の温度を保っています。これは氷が周りから熱を奪うことで水に変わっているので、解けるまでは温度は変わらないということです。
完全に溶ければ、温度はどんどん室温へと近づいていきます。
2.溶解熱
では、次は氷水に『塩』をかけてみましょう。
物質が解けるには『溶解熱』というものが存在します。この溶解熱は物質によって熱を奪ったり(吸熱)、熱を与えたり(発熱)します。
塩の場合は吸熱なので温度が下がります。塩がとけるには周りからエネルギーが必要なわけですね。
つまり、まず塩が溶けることで温度が下がるというわけです。しかし、確かに温度は下がりますが、溶解熱だけではそこまで温度は下がりません。
実は塩には別の働きがあるのです。塩はただ解けて溶解熱によって、氷水の温度を下げていたわけではないのです。
3.凝固点降下
氷というのは水分子がお互いに手を取り合って、しっかり結合した状態であると先ほども言いました。
例えば、手を取り合おうとしているのに邪魔者が入って来たとします。そうなれば、なかなかうまく手を取り合えないですよね。
それと同じで実は塩が入ってくることで、氷になりにくくなってしまうのです。
このように物質が溶けた状態の凝固点が低くなることを、『凝固点降下』とよんでいます。
25%の食塩水であれば、凝固点が約ー22℃にもなってしまうのだから驚きです。
その結果、氷が水へと変わる融解熱と塩が溶けることで奪われる溶解熱により、たとえ0℃を下回ったとしても塩水は凍ることはないのです。
どんどん温度は下がっていきます。
4.凍結防止剤
冬になると地面に謎の白い粉がまかれていることがありますよね?
実はこの粉は道路の凍結を防止するためにまかれた『凍結防止剤』です。
道路が凍ってしまったら車がスリップしてしまったり、歩いているとこけてしまうので大変危険ですよね。
この凍結防止剤は、まさにこの凝固点降下を利用しているのです。
凍結防止剤には塩のほかには、塩化カルシウムや塩化マグネシウムが、使用されています。
5.さいごに
塩をかければ冷えるんだったら砂糖はどうなんだ?
今回お話した氷水に塩をかけると温度が下がる原理を知っていれば、そう思われる方もいると思います。
それはとても良いかんがえですが、塩の分子量と砂糖の分子量を比べてください。
圧倒的に砂糖の方が大きいことが分かります。
凝固点降下はたくさん溶ける方がより働くため、分子量が大きな砂糖を溶かすよりも塩を水に溶かす方が効率が良いというわけです。
砂糖と塩のどちらが溶けやすいのか?ということに関して、もっと詳しく⇩で説明しているので気になる方は読んでみて下さい。
自由研究などで塩以外に様々なものをふりかけてみて温度を計ったり、溶かした水を凍らせてみるのも面白そうですよね。















